4/23 化学课 - 可逆反应与平衡状态
可逆反应
正反应:
逆反应:
- 定义:在同一条件下,既能向正反应方向进行又能向逆反应方向进行的反应
- 特点
- 在同一条件下进行
- 正逆反应同时存在
- 反应物生成物共存
- 表示方式:可逆反应化学方程式中常用 $\ce {<=>}$
溶解平衡
在一定条件下,当溶质溶解的速率等于结晶的速率,固体溶质不再减少,也不再增加,溶液处于饱和状态,称之为达到了溶解平衡状态,简称溶解平衡。
化学平衡状态
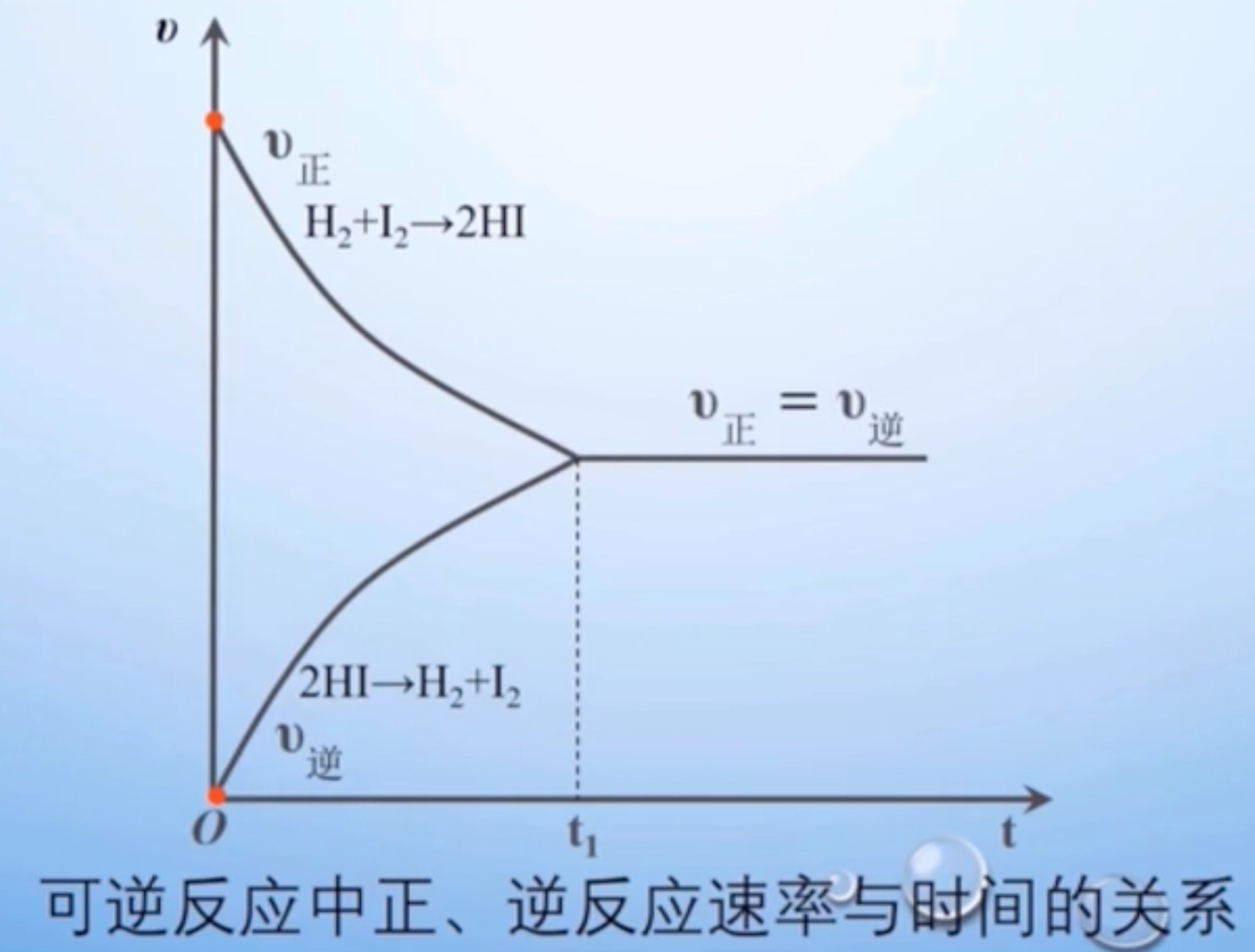
- 在一定条件下的可逆反应中,正反应速率和逆反应速率相等,反应混合物中各组分的浓度保持不变的状态,称之为化学平衡状态,简称化学平衡。
- 化学平衡状态是可逆反应在一定条件下所能达到的最大限度。
化学平衡的特征
- 研究对象:可逆反应
- 实质:$v_正 = v_逆$
- 达到化学平衡时,正逆反应还在进行:$v_正 = v_逆 ≠ 0$
- 现象:达到化学平衡时反应混合物中各物质的浓度不再发生变化
- 若改变浓度、温度、压强等反应条件,化学平衡会被破坏
| 条件 | $v_正$ | $v_逆$ |
|---|---|---|
| 扩大容器体积 | $\downarrow$ | $\downarrow$ |
| 使用合适的催化剂 | $\uparrow$ | $\uparrow$ |
| 升高温度 | $\uparrow$ | $\uparrow$ |
| 体积不变,充入$\ce {N2}$ | $\uparrow$ | 随之 $\uparrow$ |
| 体积不变,充入$\ce {NH3}$ | 随之 $\uparrow$ | $\uparrow$ |
| 体积不变,充入$\ce {He}$ | $\times$ | $\times$ |
| 压强不变,充入$\ce {He}$ | $\downarrow$ | $\downarrow$ |
判断
单位时间内有$3 \text { mol }\ce {H2}$参加反应,$1 \text { mol }\ce {N2}$生成。
正确:因为两个条件分别可以求出正反应速率和逆反应速率。

