第四章 - 剖析物质变化中的能量变化
物质在溶解过程中有能量变化
物质变化中的能量变化:
- 能量守恒定律:能量在各种形式之间的转换和各个物体之间的转移过程中,各种形式的能量综合保持不变。
- 物理变化:意义:$1 \text {mol}$液态水变成气体,吸收$44\text { kJ}$的热量。
- 化学变化:意义:$1 \text { mol}$的固态$\ce {C}$和$1 \text { mol}$的氧气反应,生成一摩尔的二氧化碳气体并放出393.5千焦的热量。要注意量、状态
溶解过程和溶解热现象
- 溶液温度升高:$\ce {NaOH (s)、浓硫酸}$
- 溶液温度降低:$\ce {NH4NO3 (s)、NH4Cl (s)}$
- 溶液温度变化不大:$\ce {NaCl (s)}$
解释:
比如:$\ce {Cu2+}$和水发生水合过程,生成水合铜离子,显蓝色
- $扩散过程中吸收的热量 > 水合过程中放出的热量 \rightarrow 溶液温度下降$
- $扩散过程中吸收的热量 < 水合过程中放出的热量 \rightarrow 溶液温度升高$
生成溶液的过程既不是物理变化,也不是化学变化,是物理化学变化
溶解和结晶
- 溶解:固体溶质扩散到溶剂中去的过程
- 结晶:固体溶质从溶液中析出的过程
溶解过程和结晶过程同时存在,是一组相反的过程
- $v_{溶解} > v_{结晶}$,固体溶解(减少),不饱和溶液
- $v_{溶解} < v_{结晶}$,固体析出(增加),饱和溶液
- $v_{溶解} = v_{结晶}$,溶解平衡,饱和溶液
溶解平衡:与外界条件(温度、溶剂量等)有关
改变外界条件(升温、加水等),原来的平衡被破坏,在新的条件下达到新的平衡 -- 平衡发生移动。
结晶水合物
- 晶体:自发形成的具有规则的几何形状的固体
- 结晶水合物:含有结晶水的固体
- 风化:室温下干燥空气中失去部分或全部结晶水的现象
- 潮解:吸收空气中的水蒸气在固体表面形成溶液的现象
- 例如氢氧化钠作为干燥剂
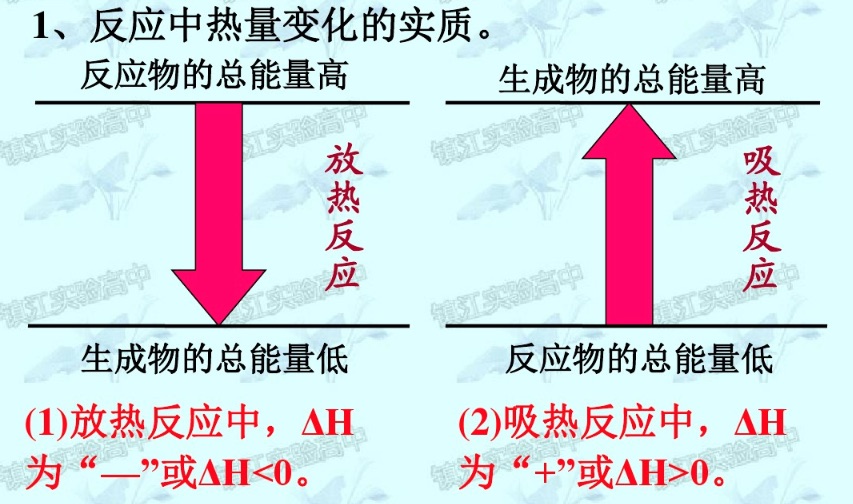
化学反应中的能量变化
化学反应中的热效应
- 化学能:只有在化学反应中才能释放出来的能量(热能、光能、……)
- 当化学反应中的能量变化表现为热量变化是:
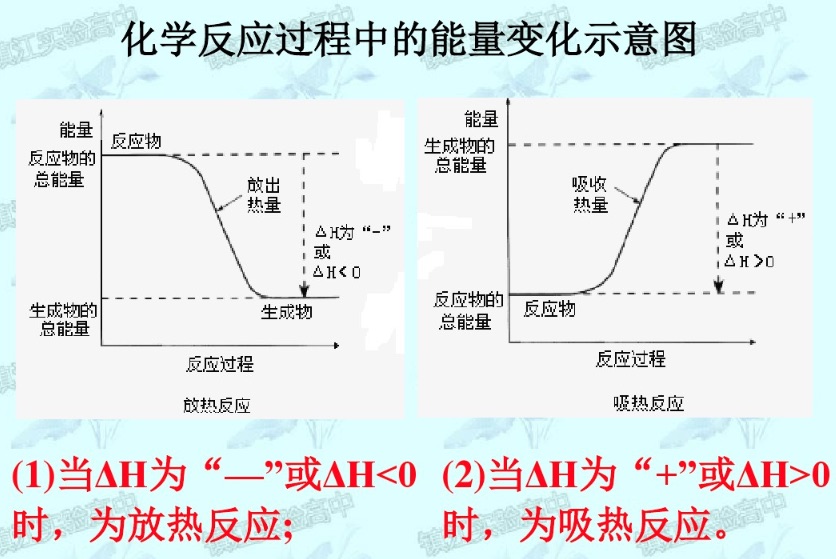
- 对于放热反应:
- 对于吸热反应:
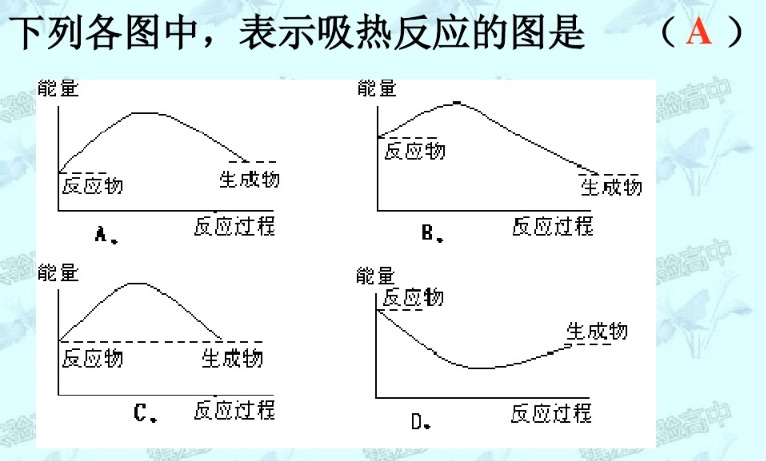
能量变化图
热化学反应方程式
表示化学反应中吸收或放出的能量的化学方程式
热化学反应方程式中可以出现分数、小数、整数,但是不可以全部是分数
热化学方程式中的系数之比不表示微粒数之比,表示物质的量
反应物、生成物必须标明状态
热化学反应方程式不用写反应条件
Tip: 想要得到想要的热化学反应方程式,可以相加减。
燃料的充分利用
铜锌原电池及其反应原理
现象:指针偏转,铜片上有气泡产生,锌片上无气泡,锌片逐渐溶解。
负极,$\ce {Zn}$:氧化反应
正极,$\ce {Cu}$:还原反应
总反应方程式
工作原理:氧化还原反应
原电池发生的反应要比一般的反应快。
原电池原理应用:
- 实验室制氢气:粗锌(多种金属) + 稀硫酸 => 形成众多原电池
- 锌 + 稀硫酸 + 硫酸铜(少量) => 置换出铜、形成原电池
- 金属的腐蚀与防护
- 铁含杂质$\ce {C}$,空气中的水膜作为电解质溶液
- 正极:析氢腐蚀
- 正极:吸氧腐蚀
- 负极:
- 防护:
- 破坏原电池: 改变金属内部结构
- 破坏原电池: 金属表面覆盖层
- 电化学保护法:焊更加活泼的金属,比如焊锌块。
- 铁含杂质$\ce {C}$,空气中的水膜作为电解质溶液

